Повышение колострального иммунитета телят
| Л.В. Харитонов, д.б.н. | ФГБНУ Всероссийский научно-исследовательский
институт физиологии, биохимии и питания животных |

|
| О.В. Харитонова, к.б.н.
| ||
| О.С. Сафронова, к.б.н.
|
06.04.2020
Источник: на правах рекламы
ПРОБЛЕМА КОРОТКО
 Проблема выращивания здорового молодняка сельскохозяйственных животных является весьма актуальной. Одним из резервов повышения продуктивности молодняка крупного рогатого скота является мобилизация механизмов неспецифической резистентности организма.
Проблема выращивания здорового молодняка сельскохозяйственных животных является весьма актуальной. Одним из резервов повышения продуктивности молодняка крупного рогатого скота является мобилизация механизмов неспецифической резистентности организма.
Уязвимым периодом онтогенеза является начальный постнатальный период, характеризующийся относительной физиологической незрелостью защитных систем, обусловленной определённой структурной незавершенностью межтканевых взаимоотношений органов и систем организма на данном этапе развития (Криштофорова Б.В. и соавт., 1994; Игнатьев Л.С., Бондаренко Н.И., 1994). Ведущее значение в этот период жизни организма имеет иммунная система, функционирование которой также претерпевает ряд значительных изменений и которая сильно подвержена негативному влиянию факторов окружающей среды (Шумов И.С., Молев А.И. и др., 2004).
СПОСОБЫ РЕШЕНИЯ ПРОБЛЕМЫ
 Проблема выращивания здорового молодняка сельскохозяйственных животных является весьма актуальной. Одним из резервов повышения продуктивности молодняка крупного рогатого скота является мобилизация механизмов неспецифической резистентности организма.
Проблема выращивания здорового молодняка сельскохозяйственных животных является весьма актуальной. Одним из резервов повышения продуктивности молодняка крупного рогатого скота является мобилизация механизмов неспецифической резистентности организма.
Уязвимым периодом онтогенеза является начальный постнатальный период, характеризующийся относительной физиологической незрелостью защитных систем, обусловленной определённой структурной незавершенностью межтканевых взаимоотношений органов и систем организма на данном этапе развития (Криштофорова Б.В. и соавт., 1994; Игнатьев Л.С., Бондаренко Н.И., 1994). Ведущее значение в этот период жизни организма имеет иммунная система, функционирование которой также претерпевает ряд значительных изменений и которая сильно подвержена негативному влиянию факторов окружающей среды (Шумов И.С., Молев А.И. и др., 2004).
СПОСОБЫ РЕШЕНИЯ ПРОБЛЕМЫ
До приема молозива отмечается низкое содержание лейкоцитов, общего белка, иммуноглобулинов. После приема молозива к концу первых суток количество лейкоцитов, общего белка и иммуноглобулинов существенно увеличивается. В последующем эти показатели снижаются (Мотузко, Никитин, 1989). Материнские антитела попадают после рождения с молозивом через стенки кишечника и служат, как и взрослым особям, для защиты против внедряющихся в организм возбудителей. Следует отметить, что пассивно приобретенный иммунитет новорождённого, направлен, прежде всего, против тех антигенов или возбудителей, с которым была в контакте мать.
В крови телят уровень иммуноглобулинов чаще всего пропорционален количеству принятого ими молозива в первые сутки после рождения. Начиная с 3 суток после рождения, концентрация Ig G в крови уменьшается в связи с распадом и элиминацией пассивно приобретенных иммуноглобулинов (Федоров, 1987). Концентрация антител в молозиве составляет в среднем 6% (6 г/100 г), но может изменяться в пределах от 2 до 23%. При этом широко варьирует и уровень всасывания. Сразу после рождения доля поглощенных антител составляет в среднем 20%, но может колебаться от 6 до 45%. В течение нескольких часов способность кишечной стенки поглощать антитела резко падает. Таким образом, даже при выпойке достаточного количества молозива с высоким уровнем иммуноглобулинов не гарантируется пропорциональное поступление антител в кровь теленка.
Выпаивание молозивом не гарантирует теленку получение пассивного иммунитета. Все зависит от времени его дачи после рождения, в течение которого теленок получит дозу «хорошего» молозива (т.е. с высоким содержанием иммуноглобулинов). Если их содержание низкое, то таким молозивом поить теленка почти бесполезно. Обычно концентрация антител (IgG) в сыворотке молозива менее 10 мг/мл свидетельствует о недостаточной пассивной передаче иммунитета. В большинстве стад с такой низкой концентрацией наблюдаются серьезные вспышки заболеваний. Содержание IgG в молозиве менее 5 мг/мл указывает о практически полном отсутствии передачи иммунитета, и такие телята имеют очень высокую смертность.
Для обеспечения гарантированного уровня обеспечения молозивными иммуноглобулинами часто применяется использование замороженного молозива. Молозиво для замораживания должно содержать иммуноглобулинов не менее 50 г/литр.
Следующим приемом является искусственное повышение потребления с молозивом иммуноглобулинов. Достигается это принудительной дачей необходимого количества молозива через зонд или дополнительным введением в молозиво сухой его формы. При этом остается неясным, увеличит ли такой прием всасывание иммуноглобулинов.
МЕТОДИЧЕСКИЕ ПОДХОДЫ
В крови телят уровень иммуноглобулинов чаще всего пропорционален количеству принятого ими молозива в первые сутки после рождения. Начиная с 3 суток после рождения, концентрация Ig G в крови уменьшается в связи с распадом и элиминацией пассивно приобретенных иммуноглобулинов (Федоров, 1987). Концентрация антител в молозиве составляет в среднем 6% (6 г/100 г), но может изменяться в пределах от 2 до 23%. При этом широко варьирует и уровень всасывания. Сразу после рождения доля поглощенных антител составляет в среднем 20%, но может колебаться от 6 до 45%. В течение нескольких часов способность кишечной стенки поглощать антитела резко падает. Таким образом, даже при выпойке достаточного количества молозива с высоким уровнем иммуноглобулинов не гарантируется пропорциональное поступление антител в кровь теленка.
Выпаивание молозивом не гарантирует теленку получение пассивного иммунитета. Все зависит от времени его дачи после рождения, в течение которого теленок получит дозу «хорошего» молозива (т.е. с высоким содержанием иммуноглобулинов). Если их содержание низкое, то таким молозивом поить теленка почти бесполезно. Обычно концентрация антител (IgG) в сыворотке молозива менее 10 мг/мл свидетельствует о недостаточной пассивной передаче иммунитета. В большинстве стад с такой низкой концентрацией наблюдаются серьезные вспышки заболеваний. Содержание IgG в молозиве менее 5 мг/мл указывает о практически полном отсутствии передачи иммунитета, и такие телята имеют очень высокую смертность.
Для обеспечения гарантированного уровня обеспечения молозивными иммуноглобулинами часто применяется использование замороженного молозива. Молозиво для замораживания должно содержать иммуноглобулинов не менее 50 г/литр.
Следующим приемом является искусственное повышение потребления с молозивом иммуноглобулинов. Достигается это принудительной дачей необходимого количества молозива через зонд или дополнительным введением в молозиво сухой его формы. При этом остается неясным, увеличит ли такой прием всасывание иммуноглобулинов.
МЕТОДИЧЕСКИЕ ПОДХОДЫ
Для решения данного вопроса нами использовалось сухое молозиво (лиофильной сушки), которое добавляли в молозиво матери при первой выпойке.
На 2.5 литра материнского молозива добавляли 50 г сухого порошка в первую выпойку. В результате опытные телята (3 головы) получали молозиво с содержанием иммуноглобулинов 68,5±2,66 г/л в первую выпойку. Контрольная группа получала только материнское молозиво. В каждой группе было по 3 теленка. Через 24 часа у подопытных животных брали кровь из яремной вены для анализа иммуноглобулинов. Затем пробы крови брали через 10, 20 и 30 дней после рождения телят для изучения состояния колострального иммунитета у новорожденных телят и становление у них неспецифической резистентности. Для этого исследовали уровень иммуноглобулинов, морфологический и биохимический состав крови и показатели неспецефической резистентности (бактерицидную, лизоцимную и фагоцитарную активность).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
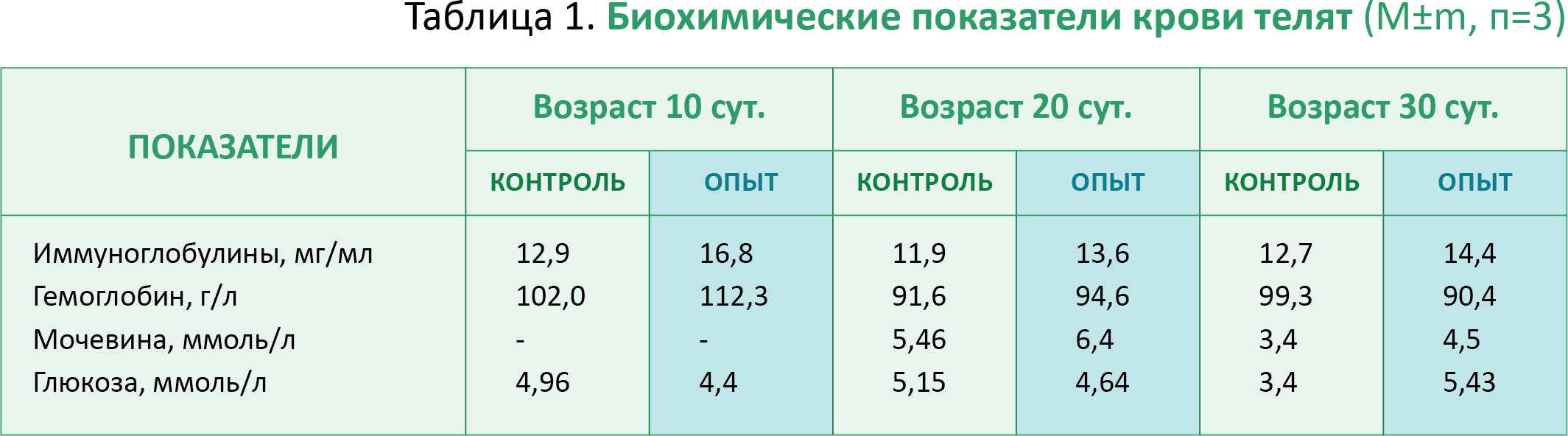
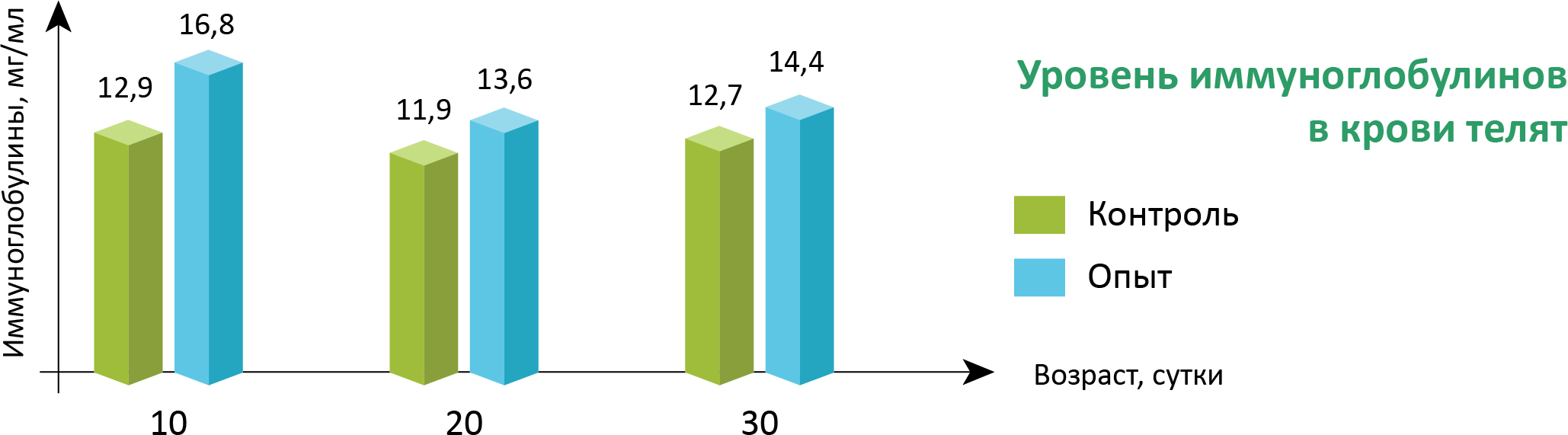
В опытной группе при выпаивании добавочного молозива новорожденным телятам отмечено повышение уровня иммуноглобулинов в крови на 10-ый день после выпаивания на 30,2% (р<0,05). Через 10 и 20 дней различие сглаживалось, но оставалось на более высоком уровне у телят опытной группы (13-14%) (табл.1).
При этом уровень гемоглобина и эритроцитов был также более высоким в крови телят опытной группы до 30 дня опыта, когда эти различия нивелировались. Показатели концентрации глюкозы и мочевины в крови, в определен- ной степени отражающие уровень и направленность азотистого обмена у животных, позволяют констатировать повышение потребления глюкозы и образования мочевины в организме телят в связи с увеличением их прироста.
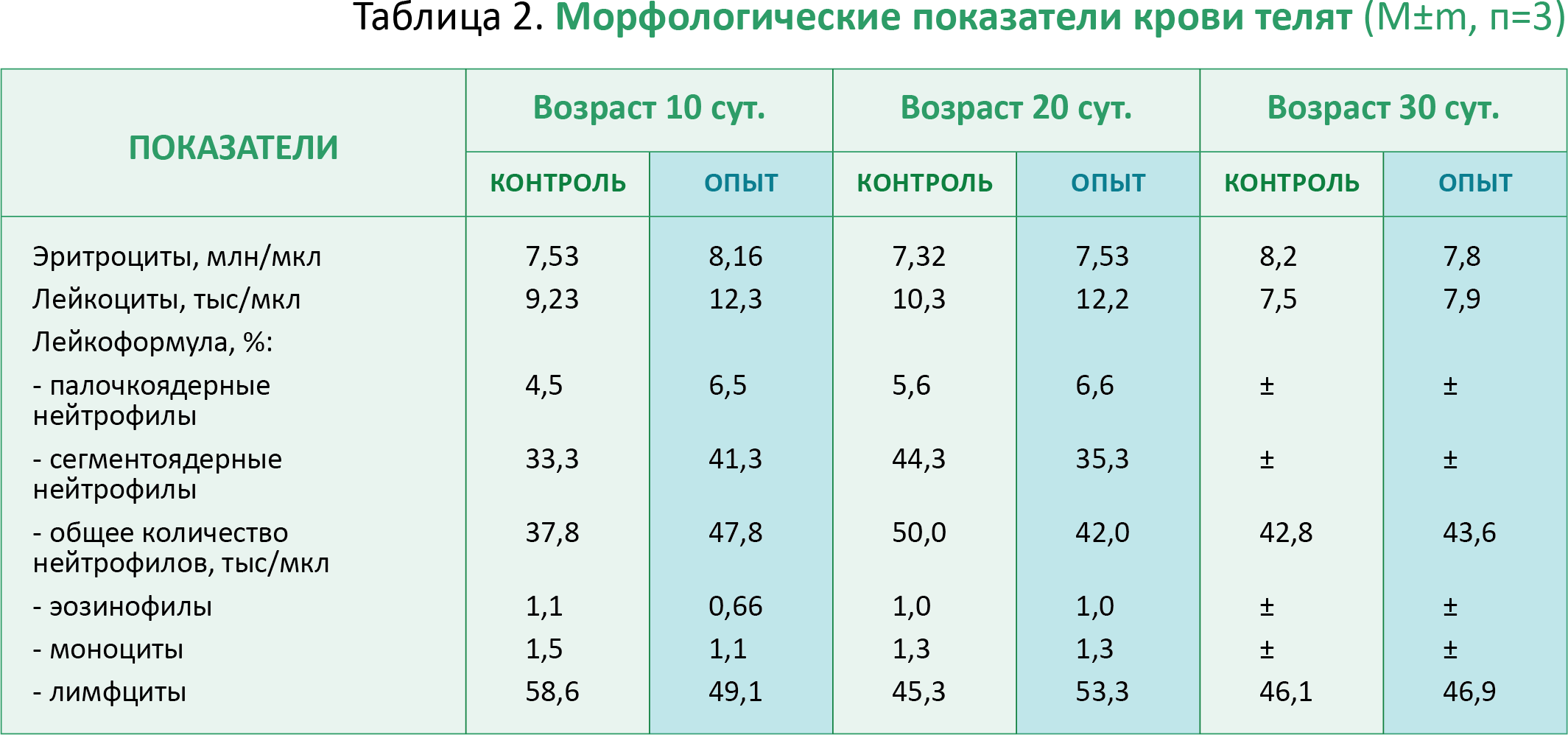
Отмечено увеличение уровня лейкоцитов у телят опытной группы во все возрастные периоды (табл.2). У животных этой же группы наблюдали повышение процента палочкоядерных нейтрофилов, являющихся предшественниками более активно функционирующих клеток. С учетом увеличения общего числа лейкоцитов повысилось и количество лимфоцитов в объеме крови при некотором снижении процента этих элементов.

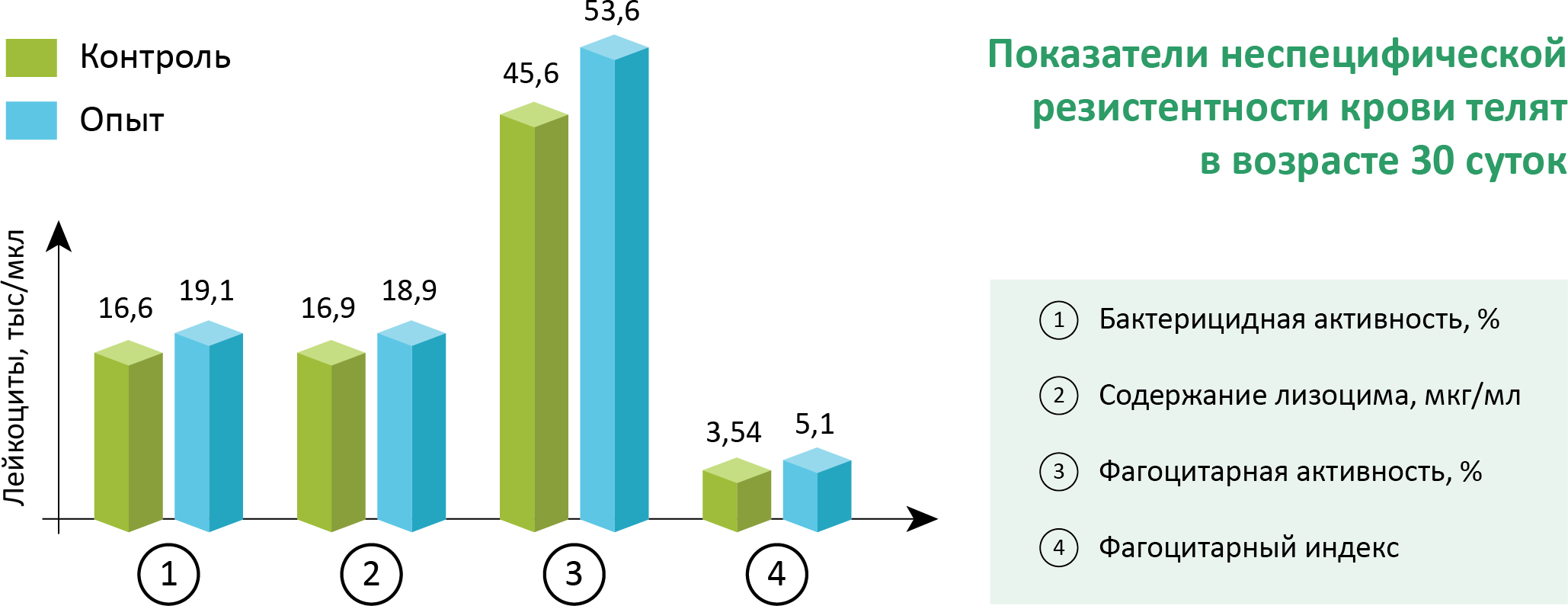
На 20-й и 30-ый день жизни телят был определен уровень отдельных иммунобиологических показателей крови, отражающих в целом состояние клеточной и гуморальной защиты организма. Было выявлено, что у телят опытной группы были выше все показатели неспецифической резистентности (табл. 3).
Показатели бактерицидной активности сыворотки крови, отражающие суммарное действие клеточного и гуморального факторов защиты (Плященко, Сидоров, 1979)., были выше у животных опытной группы на 15 отн.% в сравнении с контролем на 30-ый день опыта. Неспецифическая форма клеточного иммунитета, как известно, проявляется фагоцитарной активностью сегментоядерных нейтрофилов. Нарастание этого показателя у телят опытной группы связано с активацией внутриклеточных систем фагоцитов и повышением опсонических способностей иммуноглобулинов. На 20– й день опыта показатель этой активности у телят, которым выпаивали дополнительное молозиво, превышал величину в контроле на 24,5 % (р< 0,05) и на 30 – й день на 17,5 отн. % ((р< 0,05); возрос в оба периода и фагоцитарный индекс (табл. 3).
Лизоцимная активность плазмы телят опытной группы была выше по сравнению с контролем в конце опыта, что можно связать с активацией макрофагов, так как лизоцим секретируется макрофагами и выделятся при дегрануляции полиморфноядерных нейтрофилов (Коваленко, 1979; Плющенко и др.,1979).
Показатели бактерицидной активности сыворотки крови, отражающие суммарное действие клеточного и гуморального факторов защиты (Плященко, Сидоров, 1979)., были выше у животных опытной группы на 15 отн.% в сравнении с контролем на 30-ый день опыта. Неспецифическая форма клеточного иммунитета, как известно, проявляется фагоцитарной активностью сегментоядерных нейтрофилов. Нарастание этого показателя у телят опытной группы связано с активацией внутриклеточных систем фагоцитов и повышением опсонических способностей иммуноглобулинов. На 20– й день опыта показатель этой активности у телят, которым выпаивали дополнительное молозиво, превышал величину в контроле на 24,5 % (р< 0,05) и на 30 – й день на 17,5 отн. % ((р< 0,05); возрос в оба периода и фагоцитарный индекс (табл. 3).
Лизоцимная активность плазмы телят опытной группы была выше по сравнению с контролем в конце опыта, что можно связать с активацией макрофагов, так как лизоцим секретируется макрофагами и выделятся при дегрануляции полиморфноядерных нейтрофилов (Коваленко, 1979; Плющенко и др.,1979).

За первый месяц выращивания телята контрольной группы имели среднесуточный прирост 701.2, а опытной 758,0 г/сут.

ВЫВОДЫ:
Таким образом, скармливание новорожденным телятам в первые сутки жизни дополни- тельного молозива воздействует на звенья иммунной системы, о чем можно судить по показателям неспецифической резистентности и уровню лимфоцитов и их активности. Это нашло отражение в повышении жизнеспособности животных, снижении их заболеваемости и увеличении прироста массы тела молодняка в среднем на 8,1% за первый месяц жизни в период молочного выращивания.
Такой подход может послужить основной для разработки практических физиологически обоснованных способов фармакопрофилактики и терапии болезней телят молочного периода выращивания, обусловленных врожденными или приобретенными иммунодефицитами.
ЛИТЕРАТУРА:
Таким образом, скармливание новорожденным телятам в первые сутки жизни дополни- тельного молозива воздействует на звенья иммунной системы, о чем можно судить по показателям неспецифической резистентности и уровню лимфоцитов и их активности. Это нашло отражение в повышении жизнеспособности животных, снижении их заболеваемости и увеличении прироста массы тела молодняка в среднем на 8,1% за первый месяц жизни в период молочного выращивания.
Такой подход может послужить основной для разработки практических физиологически обоснованных способов фармакопрофилактики и терапии болезней телят молочного периода выращивания, обусловленных врожденными или приобретенными иммунодефицитами.
ЛИТЕРАТУРА:
1. Белокрылов Г. А., Молчанова И. М., Сорочинская Е. И. Аминокислоты как стимуляторы иммуногенеза. Доклад А. Н. СССР, 1986, 2; 289
2. Великанов В. И., Шумов И. С., Маслова М. А., Харитонов Л. В. Состояние неспецифической резистентности новорожденных телят под воздействием препаратов аминокислот. Матер. ХУШ межд. конф. «Новые фармакологические средства в ветеринарии». СПб, 2006; 49-50.
3. Воробьев А. А., Лященко В. А. Иммунобиологические препараты: настоящее и будущее. ЖМЭИ. 1995, 6: 105-111.
4. Иванов И. С., Шамберев Ю. Н., Гаврищук В. И. Повышение резистентности животных при инъекции аспарагиновой кислоты. Известия ТСХА, 2004, 3: 101-106.
5. Ивашкин В. Т. Метаболическая организация функций желудка. Л., 1981.
6. Коваленко Я. Р. Формирования иммунобиологического статуса у молодняка сельскохозяйственных животных. Вестник с.-х. науки, 1979, 2: 50-58.
7. Кондрахин И. П., Курилов Н. В., Малахов А. Г. И др. Клиническая лаборатория диагностики в ветеринарии. Справочное издание. М., 1985, 287 с.
8. Методы биохимического анализа. Справочное пособие (под ред. акад. Б. Д. Кальницкий). Боровск, 1997.

| Всероссийский научно-исследовательский институт
физиологии, биохимии и питания животных (ВНИИФБиП) 249013, Калужская область, г. Боровск, тел.: 8 (495) 996-34-15 | www.bifip.ru | vniifbib@mail.ru |
регион:
Россия



















