Влияние защищённого метионина на здоровье молочных коров

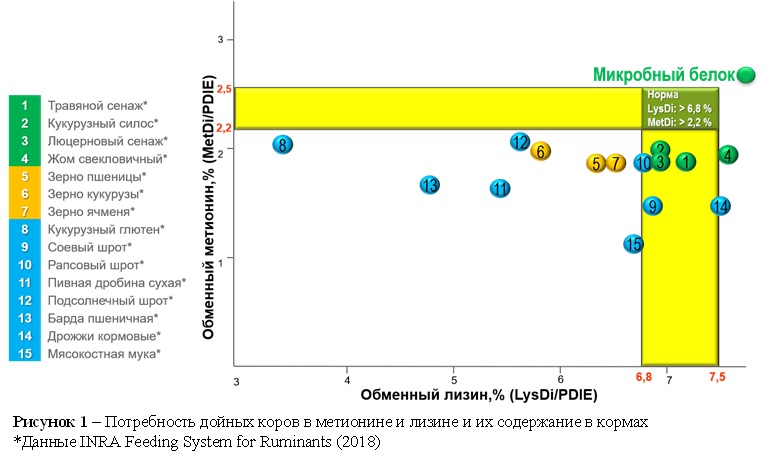
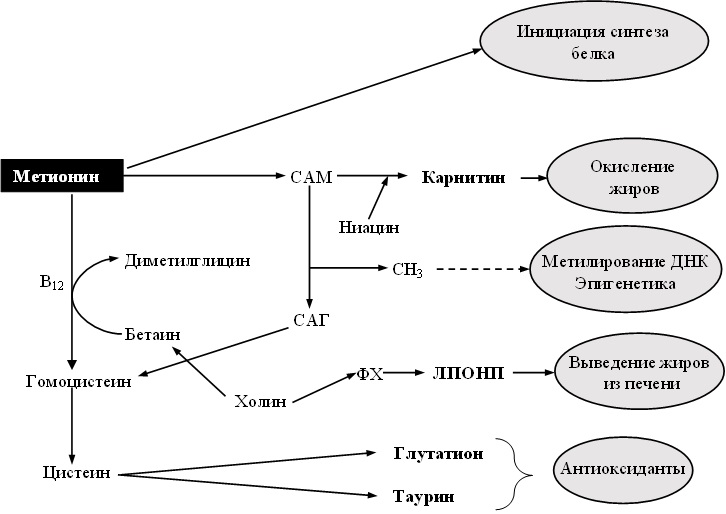
Рисунок 2 – Роль метионина в обмене веществ коровы (21)
Пояснения: CH3 – метильные группы; САМ – S-Аденозилметионин; САГ – S-Аденозилгомоцистеин; ФХ – Фосфатидилхолин; ЛПОНП – липопротеины очень низкой плотности
Если же говорить об эффектах, которые данная аминокислота оказывает на животных, то учитывая, что метионин – это единственная аминокислота, с которой начинается синтез любого белка (34), его нехватка может негативно сказываться практически на всех процессах, протекающих в организме, будь то синтез молочного протеина, рост плода или синтез гормонов. Влиянию метионина на молочную продуктивность и содержание белка в молоке уже было посвящено множество статей за рубежом (8, 12, 26, 30) и несколько на русском языке (И. Айснер, 2015, Защищённые аминокислоты в кормлении коров; И. Айснер, 2016, Эффективность применения защищённого от разрушения в рубце метионина Смартамин® М в кормлении молочных коров). Основной эффект, оказываемый метионином на молочную продуктивность связан как раз с увеличением эффективности использования транзитного протеина. Однако помимо участия в синтезе метионин сам по себе играет важную роль в регуляции множества других физиологических процессов (рис. 2).
Например, метионин является предшественником таких веществ как таурин и глутатион – основных антиоксидантов в организме животного. Он также необходим для выведения жиров из печени и их окисления. В данной статье мы подробнее рассмотрим все эти и многие другие функции метионина, оказывающие непосредственное влияние на здоровье молочных коров.
Насколько важны аминокислоты в транзитный период?
В период перед отёлом потребление коровами сухого вещества может снижаться несмотря на то, что потребность в питательных веществах, наоборот, увеличивается для поддержания роста плода, плаценты и тканей молочной железы (2). В первые недели после отёла потребление корма также может оставаться на низком уровне, при том, что потребности животного продолжают расти в связи с начавшейся лактацией и необходимостью восстановления после отёла. В результате сочетание этих двух факторов приводит к возникновению отрицательного баланса питательных веществ и энергии, а также дефициту некоторых макроэлементов, что в свою очередь, может вести к ухудшению функции печени и иммунитета и возникновению субклинического кетоза и других расстройств обмена веществ (11, 13, 32). В этот период организм животного мобилизует собственные резервы, в частности жиры, белки и гликоген (21). Общая масса протеина, который мобилизуется в начале лактации, может достигать 20 кг на одну корову (6, 19, 20). Большая часть этого протеина поступает из периферических тканей, в основном – скелетных мышц (23), и, в меньшей степени, из кожных покровов засчёт угнетения синтеза белков в этих тканях и усиленному протеолизу, то есть расщеплению белков (3). Высвободившиеся в результате этих процессов аминокислоты активно используются для синтеза белка молока, получения ряда других биологически активных веществ или глюконеогенеза для получения глюкозы (23).
Влияние метионина на здоровье печени
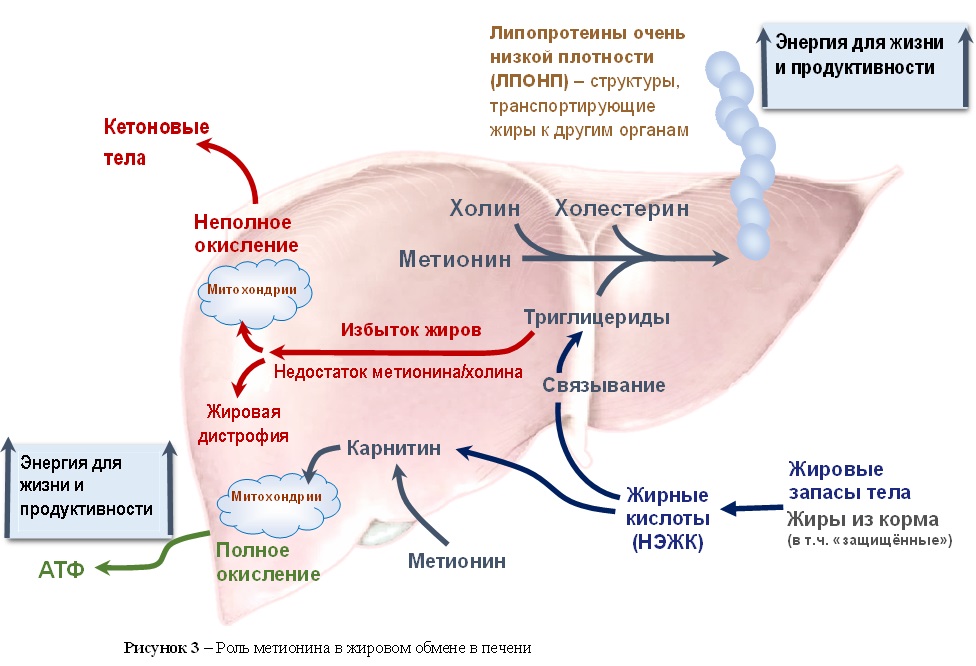
В период позднего сухостоя для обеспечения организма коровы энергией, необходимой для перестройки обмена веществ перед отёлом и лактацией, начинается мобилизация жиров из жировой ткани. В кровь они поступают в виде неэстерифицированных или, проще говоря, свободных жирных кислот (НЭЖК или СЖК), в печени из СЖК синтезируются триглицериды. Когда недостаток энергии значителен, и концентрация СЖК в крови существенно повышается, начинает снижаться чувствительность клеток к инсулину, что негативно влияет на их способность усваивать глюкозу, а это, в свою очередь, ведёт к снижению аппетита (24). В результате снижения потребления сухого вещества дефицит энергии только усиливается и стимулирует ещё более интенсивную мобилизацию жира. В итоге в клетках печени коровы в транзитный период может накапливаться большое количество жиров, что является одним из основных факторов риска развития послеотёльных осложнений (13). Накопление жиров в печени происходит в большинстве случаев из-за недостаточного синтеза липопротеинов очень низкой плотности (ЛПОНП), которые являются основным переносчиком триглицеридов в организме. (Рис. 3).
|
Таблица 1. Биохимические параметры плазмы крови у коров с нормальной функцией печени (НФП) и с жировой дистрофией печени (ЖДП) (29) | ||||||||
|
|
Группа коров |
Дни до и после отёла |
|
АНОВА | ||||
|
|
-30 |
-14 |
1 |
14 |
30 |
|
P1 | |
|
БОМК, мкмоль/л |
ЖДП |
423±81 |
415±74 |
1022±331a |
1287±775a |
1961±1241 |
|
0.0049 ** |
|
НФП |
428±36 |
453±88 |
675±305b |
610±225b |
786±268 | |||
|
СЖК, мг-экв/л |
ЖДП |
301±63 |
298±137 |
779±321 |
1186±277a |
616±336 |
|
0.0719 |
|
НФП |
172±46 |
194±69 |
744±391 |
639±143b |
426±196 | |||
|
Метионин, пмоль/л |
ЖДП |
26±2 |
23±2 |
21±2 |
18±3 |
17±3 |
|
0.0088 ** |
|
НФП |
26±3 |
26±2 |
26±4 |
23±2 |
22±6 | |||
|
1 дисперсионный анализ (** – P<0,01) a, b различные буквенные индексы означают разницу при P < 0,05 между двумя группами при одновременном отборе проб. | ||||||||
|
Таблица 2. Влияние МетаСмарта® или Смартамина® М на маркеры функции печени при введении в рацион в транзитный период (25). | |||||
|
Маркер |
Рацион |
|
P-значение | ||
|
Контроль |
МетаСмарт® |
Смартамин® М |
|
| |
|
Карнитин, нмоль/г ткани |
37,5 |
98,2 |
66,0 |
|
0,01 |
|
Фосфатидилхолин, мкмоль/г ткани |
10,6 |
7,7 |
9,1 |
|
0,15 |
|
Альбумин, г/л |
35,1 |
36,1 |
35,7 |
|
0,28 |
На данный момент уже хорошо известно, что воспалительные процессы играют важную роль в возникновении послеотёльных осложнений, однако факторы и пути развития воспалений в этот период ещё не до конца ясны. В качестве самой очевидной причины можно указать различных инфекционных агентов, но они, тем не менее, далеко не всегда являются инициаторами возникающих в организме воспалительных процессов и связанных с ними осложнений (7). В частности, очень высокую частоту возникновения подобных осложнений у коров с упитанностью свыше 3,5 баллов (по 5-балльной шкале) сложно списать исключительно на инфекции (9, 28).
|
| |||||
|
Маркер |
Рацион |
|
P-значение | ||
|
Контроль |
МетаСмарт® |
Смартамин® М |
|
| |
|
Церулоплазмин, мкмоль/л |
3,02 |
2,68 |
2,71 |
|
0,03 |
|
САА, мкг/мл |
61,0 |
40,7 |
43,5 |
|
0,17 |
|
СПРК, моль/л |
11,9 |
12,9 |
12,4 |
|
0,05 |
|
Глютатион, мМ |
1,27 |
1,55 |
1,73 |
|
0,09 |
|
| ||||
|
|
Рацион | |||
|
|
Контроль |
МЕТ |
ХОЛ |
МЕТ+ХОЛ |
|
Задержка последа |
5a |
2b |
3b |
0c |
|
Мастит |
3a |
1b |
1b |
0b |
|
Смещение сычуга |
4a |
1b |
0b |
0b |
|
Проблемы с маткой |
3a |
0b |
0b |
0b |
|
Парез |
4a |
2b |
2b |
0c |
|
Дистоция |
5a |
2b |
2b |
0c |
|
Кетоз |
3a |
1b |
1b |
0b |
|
Проблемы с конечностями |
1 |
0 |
0 |
0 |
|
| ||||
® Владелец торговых знаков Смартамин® и МетаСмарт® компания Адиссео Франс САС, Франция
Список литературы
1) Ardalan M., Rezayazdi K., and Dehghan‐Banadaky M. 2010. Effect of rumen‐protected choline and methionine on physiological and metabolic disorders and reproductive indices of dairy cows. J. Anim. Physiol. Anim. Nutr. 94: e259–e265.
2) Bell A. W. 1995. Regulation of organic nutrient metabolism during transition from late pregnancy to early lactation. J. Anim. Sci. 73:2804-2819.
3) Bell A. W., Burhans W. S., and Overton T. R. 2000. Protein nutrition in late pregnancy, maternal protein reserves and lactation performance in dairy cows. Proc. Nutr. Soc. 59:119–126.
4) Bernabucci U., Ronchi B., Lacetera N., and Nardone A. 2005. Influence of body condition score on relationships between metabolic status and oxidative stress in periparturient dairy cows. J. Dairy Sci. 88:2017-2026
5) Bertoni G., and Trevisi E. 2013. Use of the liver activity index and other metabolic variables in the assessment of metabolic health in dairy herds. Vet. Clin. Food Anim. 29:414-431
6) Botts R. L., Hemken R. W., and Bull L. S. 1979. Protein reserves in the lactating dairy cow. J. Dairy Sci. 62:433–440.
7) Bradford B. 2009. Inflammation and transition cow disorders. Proc. 4-State Dairy Nutrition and Management Conf. p.76
8) Cho J., Overton T.R., Schwab C.G., Tauer L.W. 2007. Determining the amount of rumen-protected methionine supplement that corresponds to the optimal levels of methionine in metabolizable protein for maximizing milk protein production and profit on dairy farms. J. Dairy Sci. 90:4908-4916.
9) Drackley J. K. 1999. Biology of dairy cows during the transition period: The final frontier? J. Dairy Sci. 82:2259-2273.
10) Durand D., Chilliard Y., and Bauchart D. 1992. Effects of lysine and methionine on in vivo hepatic secretion of VLDL in the high yielding dairy cow. J. Dairy Sci, 75(Suppl 1), 279.
11) Gerloff B. J., Herdt T., and Emery R. S. 1986. Relationship of hepatic lipidosis to health and performance in dairy cattle. J.Amer. Vet. Med. Assoc. 188:845-850.
12) Giallongo F., Harper M. T., Oh J., Lopes J. C., Lapierre H., Patton R. A., Parys C., Shinzato I. and Hristov, A. N. 2016. Effects of rumen-protected methionine, lysine, and histidine on lactation performance of dairy cows. J. Dairy Sci. 99:4437-4452.
13) Goff J. P. and Horst R. L. 1997. Physiological changes at parturition and their relationship to metabolic disorders. J. Dairy Sci. 80:1260-1268.
14) Gruffat D., Durand D., Graulet B., and Bauchart D. 1996. Regulation of VLDL synthesis and secretion in the liver. Reprod. Nutr. Develop.36:375-389.
15) Grummer, R. R. 1993. Etiology of lipid-related metabolic disorders in periparturient dairy cows. J. Dairy Sci. 76:3882-3896.
16) Katsumata M., Kawakami S., Kaji Y., Takada R. and Dauncey M.J. 2001. Low lysine diet selectively upregulates muscle GLUT4 gene and protein expression during postnatal development. Energy metabolism in animals EAAP publication No. 103. 237-239
17) Katsumata M., Matsumoto M., and Kaji Y. 2003. Effects of a low lysine diet on glucose metabolism in skeletal muscle of growing pigs. In: Souffrant W.B. and C.C. Metges (editors), Progress in research on energy and protein metabolism. Wageningen Academic Publishers, Wageningen, the Netherlands, EAAP publication No. 109, 187-190.
18) Katsumata M., Kyoya T., Kobayashi H., Ishida A., Ashihara A. and Nakashima K. 2013. Mechanisms of regulation of intramuscular fat deposition in porcine muscle by dietary lysine content. In Energy and protein metabolism and nutrition in sustainable animal production (pp. 253-259). Wageningen Academic Publishers.
19) Komaragiri M. V., and Erdman R. A. 1997. Factors affecting body tissue mobilization in early lactation dairy cows. 1. Effect of dietary protein on mobilization of body fat and protein. J. Dairy Sci. 80:929–937.
20) Komaragiri M. V., Casper D. P., and Erdman R. A. 1998. Factors affecting body tissue mobilization in early lactation dairy cows. 2. Effect of dietary fat on mobilization of body fat and protein. J. Dairy Sci. 81:169–175.
21) Kuhla B., Nürnberg G., Albrecht D., Görs S., Hammon H. M., and Metges C. C. 2011. Involvement of skeletal muscle protein, glycogen, and fat metabolism in the adaptation on early lactation of dairy cows. J. proteome research, 10:4252-4262.
22) Luchini D. and Loor J. 2014. The benefits of feeding methionine during the transition phase. Proc. 4-State Dairy Nutrition and Management Conf. 14-18.
23) Meijer G. A., Van der Meulen J., Bakker J. G., Van der Koelen C. J., and Van Vuuren A. M. 1995. Free amino acids in plasma and muscle of high yielding dairy cows in early lactation. J. Dairy Sci. 78:1131–1141.
24) Ohtsuka H., Koiwa M., Hatsugaya A., Kudo K., Hoshi F., Itoh N., and Kawamura S. I. 2001. Relationship between serum TNF activity and insulin resistance in dairy cows affected with naturally occurring fatty liver. J.Vet. Med. Sci. 63:1021-1025.
25) Osorio J. S., Trevisi E., Ji P., Drackley J. K., Luchini D., Bertoni G. and Loor J. J. 2014. Biomarkers of inflammation, metabolism, and oxidative stress in blood, liver, and milk reveal a better immunometabolic status in peripartal cows supplemented with Smartamine M or MetaSmart. J. Dairy Sci. 97:7437-7450.
26) Patton R.A. 2010. Effect of rumen-protected methionine on feed intake, milk production, true milk protein concentration, and true milk protein yield, and the factors that influence these effects: a meta-analysis. J. Dairy Sci. 93:2105-2118.
27) Pessayre D., Fromenty B., and Mansouri A. 2004. Mitochondrial injury in steatohepatitis. Eur. J. Gastroenterol. Hepatol. 16:1095-1105.
28) Roche J. R., Friggens N. C., Kay J. K., Fisher M. W., Stafford K. J., Berry D. P. 2009. Invited review: Body condition score and its association with dairy cow productivity, health, and welfare. J. Dairy Sci. 92: 5769-5801
29) Shibano K. I., and Kawamura S. 2006. Serum free amino acid concentration in hepatic lipidosis of dairy cows in the periparturient period. J.Vet. Med. Sci. 68:393-396.
30) Socha M.T., Putnam D.E., Garthwaite B.D., Whitehouse N.L., Kierstead N.A., Schwab C.G., Ducharme G.A., Robert J.C. 2005. Improving intestinal amino acid supply of pre- and postpartum dairy cows with rumen-protected methionine and lysine. J. Dairy Sci. 88:1113-1126.
31) Spears J. W., and. Weiss W. P 2008. Role of antioxidants and trace elements in health and immunity of transition dairy cows. Vet. J. 176:70-76.
32) Wasserman, R. H., Comar, C. L., Schooley, J. C., & Lengemann, F. W. (1957). Interrelated effects of L-lysine and other dietary factors on the gastrointestinal absorption of calcium 45 in the rat and chick (Abstract). Journal of Nutrition, 62, 367-376.
33) Waldron M. R., 2014. Prescribed Feeding Prepartum for improved Health and Performance Postpartum. Proc. 3-State Dairy Nutrition Conf. 27-39.
34) Wu. G. 2013. Amino acids – Biochemistry and Nutrition. CRC Press, Taylor and Francis Group, 6000 Broken Sound Parkway NW, Suite 300, Boca Raton, FL.
35) Zhao X., and Lacasse P. 2008. Mammary tissue damage during bovine mastitis: Causes and control. J. Anim. Sci. 86:57-65.



















