Кормовой белок сои: плохой или хороший? Биотрансформации
Автор: Архипов М. Ю., кандидат технических наук по специальности Биотехнология, ведущий специалист компании ООО "ФидИндастриз"
29.09.2017
Источник: SoyaNews
Почему некоторые источника белка в рационах кормов являются плохими или недостаточно хорошими? И что является критериями кормового белка?
Тема белка очень обширна, часто анализируют аминокислотный профиль и профиль доступных аминокислот и т.д. Но хотелось бы остановиться на другом - в каком виде должен поступать белок по своему фракционному составу? Возьмём для примера близкий к идеальному по аминокислотному профилю соевый белок, рассмотрим его фракционный состав и его трансформацию с помощью ферментирования.
Теория оптимальной структуры белка
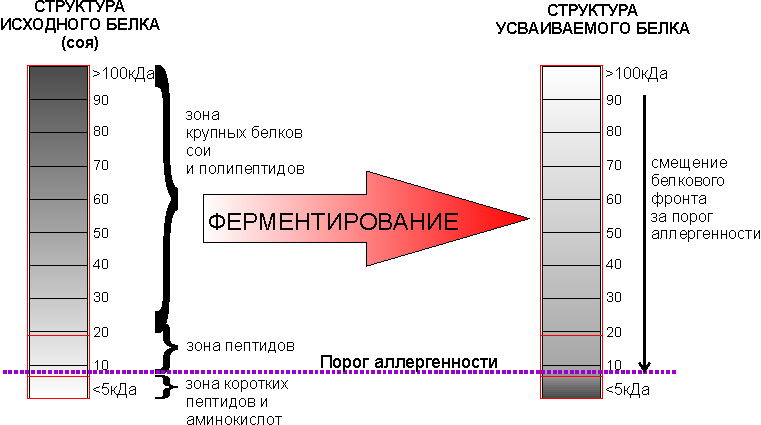
Известно, что поступившие белки не усваиваются в нативном состоянии, а претерпевают трансформацию в ЖКТ: они гидролизуются до более простых соединений – полипептидов, олигопептидов (малых или коротких пептидов) и аминокислот. Эти соединения подходят в качестве строительного материала и лишены аллергенных свойств. Тогда почему же всё чаще и чаще сталкиваемся с аллергией при потреблении тех или иных белков? Гидролизованный белок не может вызвать аллергическую реакцию в крови. Да, действительно так, но причина в том, что в организме происходит не полный гидролиз белков, часть - остаётся в нативном состоянии и они вызывают аллергию. В нативном состоянии остаются около 10% всех белков, 40% гидролизуется до пептидов, а 50% - до аминокислот, т.к. организму для строительства требуются элементы разного размера. Фракционную структуру идеального белка можно схематично представить в виде пирамиды:

Хорошо ли иметь белок в виде только аминокислот или в виде пептидов? Ответ очевиден - лучше иметь оптимальную смесь, т.к. получив только аминокислоты организм будет вынужден заново создавать пептиды и белки, которые пойдут на нужды организма. Поэтому лучше дать белок в том виде, который будет претерпевать минимум трансформаций. Входящий белок обычно имеет иную структуру – обратную – много белков, мало пептидов и свободных аминокислот. С целью его трансформации проводят процесс ферментирования, с помощью которого получают оптимальный по фракционному составу белок:

Хорошо ли иметь белок в виде только аминокислот или в виде пептидов? Ответ очевиден - лучше иметь оптимальную смесь, т.к. получив только аминокислоты организм будет вынужден заново создавать пептиды и белки, которые пойдут на нужды организма. Поэтому лучше дать белок в том виде, который будет претерпевать минимум трансформаций. Входящий белок обычно имеет иную структуру – обратную – много белков, мало пептидов и свободных аминокислот. С целью его трансформации проводят процесс ферментирования, с помощью которого получают оптимальный по фракционному составу белок:

Трансформированный белок имеет также дополнительный бонус в виде существенно сниженного содержания антипитательных факторов, к которым относится аллергенность, ингибиторы трипсина и лектины. Т.к. их носителями являются только нативные белки и их крупные полипептиды. Порог аллергенности находится около 3-7 кДа, что соответствует границе, выше которой располагаются нативные белки и их крупные полипептиды, а ниже - короткие пептиды и аминокислоты.
Размер белков имеет значение
Размер белков обычно определяется электрофорезом в полиакриламидном геле в диссоциирующей системе с использованием сульфата натрия в качестве детергента. На электрофореграмме видно распределение белка по размеру. Трансформацию соевого белка после ферментирования на электрфореграмме можно легко уловить по смещению белкового фронта:
На примере ниже представлена электрофореграмма соевых белковых продуктов: соевой муки при разном разведении, сои и ферментированного соевого белка. В сое и соевой муке видны крупные белковые аллергенные соединения сои: полипептиды конглицинина, кислые и основные полипептиды глицинина. При этом спектры включают белки с молекулярной массой от 4-х до 97-ми kDa.

Слева на электрофореграмме белки соевой муки различной концентрации (%), обработанных β-меркаптоэтанолом, кг α, кг α' и кг β -- субъединицы конглицинина, гк и го – кислые и основные субъединицы глицинина, соответственно, Г -- глицинин, Кг –конглицинин, справа -электрофореграммы нативной сои и ферментированного соевого белка (обозначены 1 и 2).
Как видно из представленного рисунка ферментирование соевого белка позволяет получить белок оптимального состава по фракционному содержанию, при котором крупных белков содержится менее 3 мг/кг.
Для оценки антипитательности белка сои часто используют другие методы: для определения аллергенности – иммуноферментный анализ, а для ингибиторов трипсина – уреазную активность или активность ингибиторов трипсина. Однако следует помнить, что эти методы могут свидетельствовать только об активности данных антипитательных белков, но не об их наличии или отсутствии.
