Экспресс-диагностика африканской чумы свиней иммунохроматографическим методом
Доклад президента АНО «НИИ ДПБ» Олега Верховского на Международном ветеринарном конгрессе в Казани.
АНО «Научно-исследовательский институт диагностики и профилактики болезней человека и животных», г. Москва, Россия
Известно, что, согласно стандартам Всемирной организации здравоохранения животных (OIE), диагностические исследования на Африканскую чуму свиней (АЧС) должны быть направлены как на идентификацию возбудителя (выделение вируса, выявление вирусного антигена, выделение и детекция геномной ДНК), так и на выявление вирус специфических антител¹. При выборе тестов следует учитывать эпидемиологическую ситуацию в конкретном регионе, форму протекания болезни и возможную вирулентность возбудителя. В нашей стране на сегодняшний день для выделения и детекции геномной ДНК вируса широко используются соответствующие тест-системы на основе полимеразной цепной реакции (ПЦР), в т.ч. в режиме «реального времени» (РВ-ПЦР) производства ГНУ ВНИИВВиМ (г. Покров), ООО «Ветбиохим» (г. Москва), ФГУН «ЦНИИ эпидемиологии» Роспотребнадзора (г. Москва). Ряд иммунологических тестов применяется как для обнаружения вируса в культуре клеток и срезах тканей, так и для выявления антител в сыворотке крови и суспензии селезенки. К первым относят реакцию гемадсорбции (РГАд) и реакцию прямой иммунофлюоресценции (РПИФ), ко вторым – иммуноферментный анализ (ИФА), метод непрямой иммунофлюоресценции (РНИФ) и иммуноблоттинг (ИБ). Все вышеперечисленные методы стали практически рутинными в лабораторной диагностике АЧС.
В 2013 году в АНО «НИИ ДПБ» была завершена разработка первой отечественной иммунохроматографической тест-системы (ИХТС) предназначенной для выявления вируса АЧС в биологическом материале инфицированных животных. Ранее с использованием двух моноклональных антител (МкА) к белку vp73 вируса АЧС была разработана и испытана тест-система в формате «сэндвич»-ИФА, предназначенная для выявления антигена вируса АЧС, с чувствительностью 5 - 10 нг/мл белка². Следующим этапом стало производство ИФА-набора («АЧС-ИФА», ООО «Ветбиохим»), который в настоящее время используется в ветеринарных лабораториях нашей страны для проведения диагностических исследований на АЧС. «Сэндвич»-ИФА и явился прототипом ИХТС, поскольку иммунологические принципы и основные специфические компоненты одинаковы для обоих методов (иммунохроматографический метод относится к одному из вариантов гомогенного ИФА и основан на латеральной диффузии реагентов по мембранному пористому носителю).
Для разработки ИХТС в качестве специфических компонентов были использованы МкА к белку vp73 вируса АЧС (№1 и №2) и МкА к IgG мыши (№3). МкА №1 в виде конъюгата коллоидного золота адсорбированы на подложке (подушке) нитроцеллюлозной мембраны и предназначены для связывания с вирусом испытуемой пробы в зоне «нанесения образца» и формирования иммунного комплекса. МкА №2 адсорбированы в «тестовой» зоне (Т) иммунострипа и предназначены для фиксации мигрирующего за счет латеральной диффузии этого иммунного комплекса. В «контрольной» зоне (С) стрипа адсорбированы МкА №3 для фиксации несвязавшихся с вирусом МкА №1 и предназначены для контроля эффективности иммунологической реакции на стрипе. Результатом реакции является наличие или отсутствие горизонтальных окрашеных полос в зонах «Т» и «С». Наличие полос в обеих зонах является положительным результатом теста (испытуемая проба содержит вирус АЧС), наличие полосы только в зоне «С» – отрицательным (рис.).
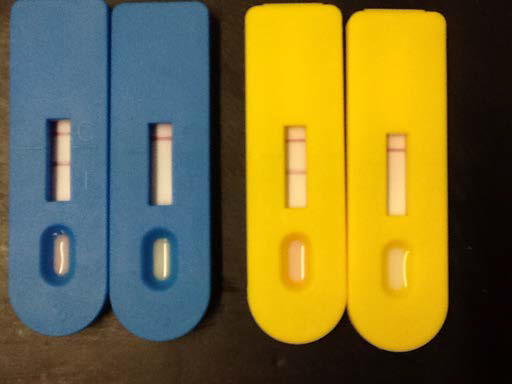
Рис. Результаты оценки эффективности двух серий ИХТС (синие и желтые пластиковые кассеты соответственно) по выявлению вируса АЧС в биологическом материале. Левые стрипы – положительная реакция, правые – отрицательная.
Оценку практической эффективности ИХТС по выявлению вируса АЧС проводили в нескольких регионах России и Республике Абхазия в лабораторных условиях с использованием проб биологического материала, взятого как от инфицированных, так и от здоровых животных (n=97, таблица).
Таблица.
|
Результаты ИХТС по выявлению вируса АЧС в практических условиях | |||
|
№ п/п |
Учреждение, где проводились испытания |
Испытуемые пробы биоматериала и их количество |
Результат испытания |
|
|
ФГБУ «ВНИИЗЖ» |
Положительные пробы (10% суспензия паренхиматозных органов) от экспериментально зараженных вирусом АЧС животных и животных из вспышек заболевания (Тверь, Воронеж), культуральная жидкость, сыворотка крови. Контрольные пробы: материал от незараженных животных. n=25. |
20 положительных проб; 5 – отрицательных |
|
|
Волгоградская областная ветеринарная лаборатория |
кровь, селезенка, костный мозг, лимфоузлы, легкое, почка. n=48. |
37 положительных проб; 11 – отрицательных |
|
|
ФГБУ «Тверская МВЛ» |
селезенка диких кабанов. n=9. |
4 положительные пробы; 5 -отрицательные |
|
|
Республика Абхазия |
пробы паренхиматозных органов от туш свиней на районных рынках. n=15. |
все пробы отрицательные |
Параллельно все испытуемые пробы (за исключением Республики Абхазия) были исследованы методами ПЦР и РПИФ. Было установлено, что результаты ИХТС и ПЦР совпали в 100% случаев при исследовании цельной крови, сыворотки крови, селезенки и печени, т.е. при исследовании биоматериала с максимально высоким содержанием вируса. После проведения испытаний был сделан основной вывод о том, что ИХТС обладает высокой чувствительностью и специфичностью, прост в постановке, удобен в использовании и применим в практических условиях для проведения скрининговых исследований на АЧС домашних свиней и диких кабанов. Таким образом, ИХТС может служить одним из средств ранней диагностики болезни и контроля за распространением вируса АЧС на территории нашей страны³.
¹ World Organization of Animal Health (OIE). African swine fever. Manual of Standards for diagnostic test and vaccines, 2012.
² Цибезов В.В. Разработка иммуноферментных методов диагностики африканской чумы свиней / В.В.Цибезов, Ю.О.Терехова, М.В.Баландина, О.Е.Латышев, Т.В.Гребенникова, О.А.Верховский, Т.И.Алипер, В.Н.Шевкопляс// Ветеринария Кубани, 2012, №1 – С.20-24.
³ В феврале 2014 г. вся нормативно-техническая документация на производство и применение набора для выявления вируса африканской чумы свиней (АЧС) иммунохроматографическим методом «АЧС-ИХМ» согласована с ФГБУ «ВГНКИ».
